Electronic Configuration
Electronic Configuration:
Electronic configuration describes how electrons are distributed among the orbitals of an atom. It follows specific rules governed by quantum mechanics and helps explain the chemical properties and reactivity of elements.
Principles of Electronic Configuration
Pauli Exclusion Principle:
No two electrons in an atom can have the same set of four quantum numbers. In a single orbital, only two electrons with opposite spins can exist.- Aufbau Principle:
Electrons fill orbitals starting from the lowest energy level to higher ones. The order of filling is based on the increasing energy of orbitals.Order of Filling (from lowest to highest energy):
Hund's Rule:
When electrons fill degenerate orbitals (orbitals of the same energy, like ), one electron enters each orbital until all are half-filled, and then pairing starts.Notation:
- The general format is , where:
- = principal quantum number (energy level),
- = orbital type (
- = number of electrons in that orbital.
Example: means the -orbital in the first energy level has 2 electrons.
Representation of Electronic Configuration
Standard Notation:
- Written as , where:
- = Principal quantum number (energy level).
- = Subshell ().
- = Number of electrons in that subshell.
- Example: (configuration for Neon).
- Written as , where:
Orbital Diagrams:
- Uses boxes or lines to represent orbitals, with arrows indicating electron spins.
- Example for oxygen ():
Examples of Electronic Configurations
1. Hydrogen ()
- Atomic number: 1
- Configuration:
- Explanation: The single electron occupies the
2. Helium ()
- Atomic number: 2
- Configuration:
- Explanation: Both electrons fill the -orbital, pairing up with opposite spins.
3. Lithium ()
- Atomic number: 3
- Configuration:
- Explanation: Two electrons fill the -orbital, and the third enters the next available -orbital.
4. Carbon ()
- Atomic number: 6
- Configuration:
- Explanation: After filling the and -orbitals, the remaining two electrons occupy separate -orbitals to minimize repulsion (Hund's Rule).
5. Neon ()
- Atomic number: 10
- Configuration:
- Explanation: All orbitals in the first and second energy levels are completely filled.
6. Sodium ()
- Atomic number: 11
- Configuration:
- Explanation: After filling the and -orbitals, the 11th electron enters the -orbital.
7. Iron ()
- Atomic number: 26
- Configuration:
- Explanation: Electrons fill orbitals up to first, and then the remaining 6 electrons occupy the -orbitals.
Special Cases
Chromium () (Atomic Number: 24):
- Expected:
- Actual:
- Explanation: A half-filled -subshell (5 electrons) is more stable, so one electron from shifts to .
- Expected:
Copper () (Atomic Number: 29):
- Expected:
- Actual:
- Explanation: A fully filled -subshell (10 electrons) is more stable, so one electron from shifts to .
Ions:
- When atoms lose or gain electrons, the electronic configuration changes.
- Example: Sodium ion ():
- Neutral Sodium:
- Sodium Ion (): (loses one electron from the orbital).
Transition Metals:
- Transition metals often have partially filled -orbitals.
- Example: Cobalt ():
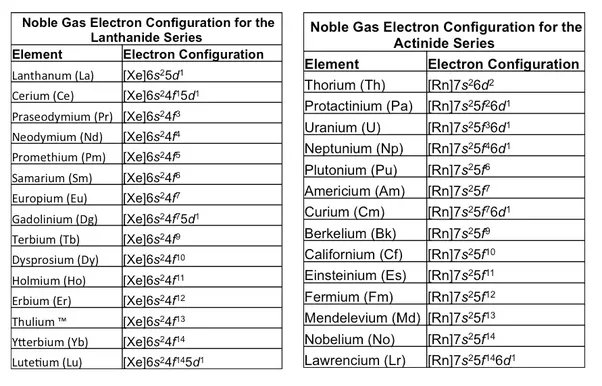
Lanthanides and Actinides:
- Electrons are added to the -orbitals.
- Example: Cerium ():
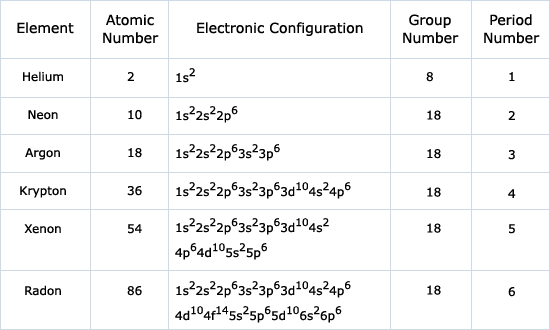
Electronic Configuration and Periodic Table
- Groups: Elements in the same group have similar valence electron configurations, determining their chemical behavior.
Example: Alkali metals (Group 1): All have . - Periods: Rows in the periodic table correspond to increasing principal quantum numbers ().
Applications
Chemical Bonding:
Electron configuration determines how atoms bond (ionic, covalent, or metallic).
Example: Carbon's allows for forming four bonds in methane ().Spectroscopy:
Electron transitions between energy levels produce characteristic spectra for identifying elements.Magnetic Properties:
Unpaired electrons result in paramagnetism, while paired electrons lead to diamagnetism.
Example: Oxygen () is paramagnetic due to unpaired electrons in -orbitals.
Significance of Electronic Configuration
Chemical Reactivity:
- Determines how elements interact in bonding.
- Example: Alkali metals () are highly reactive due to their single valence electron.
Periodic Trends:
- Explains trends in ionization energy, atomic size, and electronegativity.
Magnetism:
- Unpaired electrons lead to paramagnetic behavior.
- Example: Oxygen () is paramagnetic due to two unpaired electrons.
Spectroscopy:
- Electron transitions between orbitals emit or absorb light at characteristic wavelengths.
इलेक्ट्रॉनिक विन्यास:
इलेक्ट्रॉनिक विन्यास यह दर्शाता है कि किसी परमाणु के ऑर्बिटल्स में इलेक्ट्रान कैसे व्यवस्थित होते हैं। यह क्वांटम यांत्रिकी द्वारा शासित कुछ विशेष नियमों का पालन करता है और तत्वों के रासायनिक गुणों और प्रतिक्रियाशीलता को समझाने में मदद करता है।
इलेक्ट्रॉनिक विन्यास के सिद्धांत
1. पॉली अपवर्जन सिद्धांत (Pauli Exclusion Principle):
- किसी भी परमाणु में दो इलेक्ट्रान एक ही चार क्वांटम संख्या साझा नहीं कर सकते।
- एक ऑर्बिटल में अधिकतम दो इलेक्ट्रान हो सकते हैं, और उनके स्पिन विपरीत होंगे।
2. ऑफबाऊ सिद्धांत (Aufbau Principle):
- इलेक्ट्रान हमेशा निम्न ऊर्जा स्तर से उच्च ऊर्जा स्तर की ओर भरते हैं।
- ऑर्बिटल्स भरने का क्रम ऊर्जा के बढ़ते स्तर पर आधारित होता है।
ऑर्बिटल्स भरने का क्रम (निम्न से उच्च ऊर्जा स्तर):
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p
3. हंड का नियम (Hund's Rule):
- जब इलेक्ट्रान समान ऊर्जा वाले ऑर्बिटल्स (जैसे ) में भरते हैं, तो पहले प्रत्येक ऑर्बिटल में एक-एक इलेक्ट्रान भरा जाता है। इसके बाद जोड़ी बनाना शुरू होता है।
इलेक्ट्रॉनिक विन्यास का निरूपण
1. मानक संकेतन (Standard Notation):
- इसे के रूप में लिखा जाता है, जहाँ:
- = प्रमुख क्वांटम संख्या (ऊर्जा स्तर)।
- = ऑर्बिटल प्रकार ()।
- = उस ऑर्बिटल में इलेक्ट्रान की संख्या।
- उदाहरण: का अर्थ है कि पहले ऊर्जा स्तर के -ऑर्बिटल में 2 इलेक्ट्रान हैं।
2. ऑर्बिटल आरेख (Orbital Diagrams):
- ऑर्बिटल्स को बॉक्स या रेखा के रूप में दिखाया जाता है, और इलेक्ट्रान के स्पिन को तीर ( या ) द्वारा दर्शाया जाता है।
- उदाहरण: ऑक्सीजन () का आरेख:
इलेक्ट्रॉनिक विन्यास के उदाहरण
1. हाइड्रोजन ()
- परमाणु संख्या: 1
- विन्यास:
- व्याख्या: एकमात्र इलेक्ट्रान -ऑर्बिटल (न्यूनतम ऊर्जा वाले ऑर्बिटल) में स्थित होता है।
2. हीलियम ()
- परमाणु संख्या: 2
- विन्यास:
- व्याख्या: दोनों इलेक्ट्रान -ऑर्बिटल में भरते हैं और विपरीत स्पिन रखते हैं।
3. लिथियम ()
- परमाणु संख्या: 3
- विन्यास:
- व्याख्या: दो इलेक्ट्रान -ऑर्बिटल में भरते हैं, और तीसरा इलेक्ट्रान अगला उपलब्ध -ऑर्बिटल में जाता है।
4. कार्बन ()
- परमाणु संख्या: 6
- विन्यास:
- व्याख्या: और -ऑर्बिटल्स में इलेक्ट्रान भरने के बाद, बचे हुए दो इलेक्ट्रान -ऑर्बिटल्स में अलग-अलग भरते हैं (हंड का नियम)।
5. नियॉन ()
- परमाणु संख्या: 10
- विन्यास:
- व्याख्या: पहले और दूसरे ऊर्जा स्तर के सभी ऑर्बिटल्स पूरी तरह भरे हुए हैं।
6. सोडियम ()
- परमाणु संख्या: 11
- विन्यास:
- व्याख्या: , , और -ऑर्बिटल्स को भरने के बाद, ग्यारहवां इलेक्ट्रान -ऑर्बिटल में जाता है।
7. लौह ()
- परमाणु संख्या: 26
- विन्यास:
- व्याख्या: इलेक्ट्रान -ऑर्बिटल तक भरते हैं, और फिर बाकी 6 इलेक्ट्रान -ऑर्बिटल्स में जाते हैं।
विशेष मामले
1. क्रोमियम () (परमाणु संख्या: 24):
- अपेक्षित:
- वास्तविक:
- व्याख्या: -ऑर्बिटल में आधा-भरा हुआ उपखण्ड (5 इलेक्ट्रान) अधिक स्थिर होता है, इसलिए से एक इलेक्ट्रान में शिफ्ट हो जाता है।
2. तांबा () (परमाणु संख्या: 29):
- अपेक्षित:
- वास्तविक:
- व्याख्या: -ऑर्बिटल में पूर्ण-भरा हुआ उपखण्ड (10 इलेक्ट्रान) अधिक स्थिर होता है, इसलिए से एक इलेक्ट्रान में शिफ्ट हो जाता है।
इलेक्ट्रॉनिक विन्यास और आवर्त सारणी
1. समूह (Groups):
- एक ही समूह के तत्वों में समान संयोजक इलेक्ट्रॉनिक विन्यास होता है, जो उनके रासायनिक व्यवहार को निर्धारित करता है।
- उदाहरण: क्षार धातुएँ (समूह 1) का विन्यास होता है।
2. आवर्त (Periods):
- आवर्त सारणी की पंक्तियाँ प्रमुख क्वांटम संख्या () के अनुसार बढ़ती हैं।
महत्त्व और अनुप्रयोग
1. रासायनिक बंधन:
- इलेक्ट्रॉनिक विन्यास यह निर्धारित करता है कि परमाणु कैसे बंध बनाते हैं (आयनिक, सहसंयोजक, या धात्विक)।
- उदाहरण: कार्बन () चार बंध बनाता है, जैसे मीथेन ()।
2. चुंबकीय गुण:
- अवयुग्मित इलेक्ट्रान पैरामैग्नेटिज़्म का कारण बनते हैं, जबकि युग्मित इलेक्ट्रान डायमैग्नेटिज़्म का कारण बनते हैं।
- उदाहरण: ऑक्सीजन () पैरामैग्नेटिक है क्योंकि इसके -ऑर्बिटल में अवयुग्मित इलेक्ट्रान हैं।
3. स्पेक्ट्रोस्कोपी:
- इलेक्ट्रॉनिक संक्रमण प्रकाश के विशिष्ट तरंगदैर्घ्य को अवशोषित या उत्सर्जित करते हैं, जो तत्वों की पहचान करने में मदद करता है।








Comments
Post a Comment