Concentration ( Molarity, Normality, Molality )
Concentration and Its Types
Concentration refers to the amount of solute present in a given quantity of solvent or solution. It is an important parameter in chemistry and is commonly expressed in different units such as Molarity (M), Normality (N), and Molality (m).
1. Molarity (M)
Definition:
Molarity is the number of moles of solute per liter of solution.
Units:
Molarity is expressed in moles per liter (mol/L or M).
Example:
If 5 moles of NaCl are dissolved in 2 liters of water, the molarity of the solution is:
Key Points:
- Molarity depends on the volume of the solution.
- Changes with temperature because volume expands or contracts.
- Commonly used in titrations and reactions in aqueous solutions.
2. Normality (N)
Definition:
Normality is the number of gram-equivalents of solute per liter of solution.
Units:
Normality is expressed in equivalents per liter (eq/L or N).
Equivalent Weight Calculation:
Where n-factor depends on:
- Acid-base reactions → Number of H⁺ or OH⁻ ions exchanged.
- Redox reactions → Electron exchange.
- Precipitation reactions → Charge on the ion.
Example:
To prepare a 1N H₂SO₄ solution, we calculate:
- Molecular weight of H₂SO₄ = 98 g/mol
- n-factor = 2 (because H₂SO₄ releases 2 H⁺ ions)
Thus, 1N H₂SO₄ solution requires 49 g of H₂SO₄ in 1 liter of solution.
Key Points:
- Normality is reaction-specific.
- Used in acid-base, redox, and precipitation reactions.
- Changes with temperature because volume depends on temperature.
3. Molality (m)
Definition:
Molality is the number of moles of solute per kilogram of solvent.
Units:
Molality is expressed in moles per kilogram (mol/kg or m).
Example:
If 0.5 moles of glucose are dissolved in 250 g of water, the molality is:
Key Points:
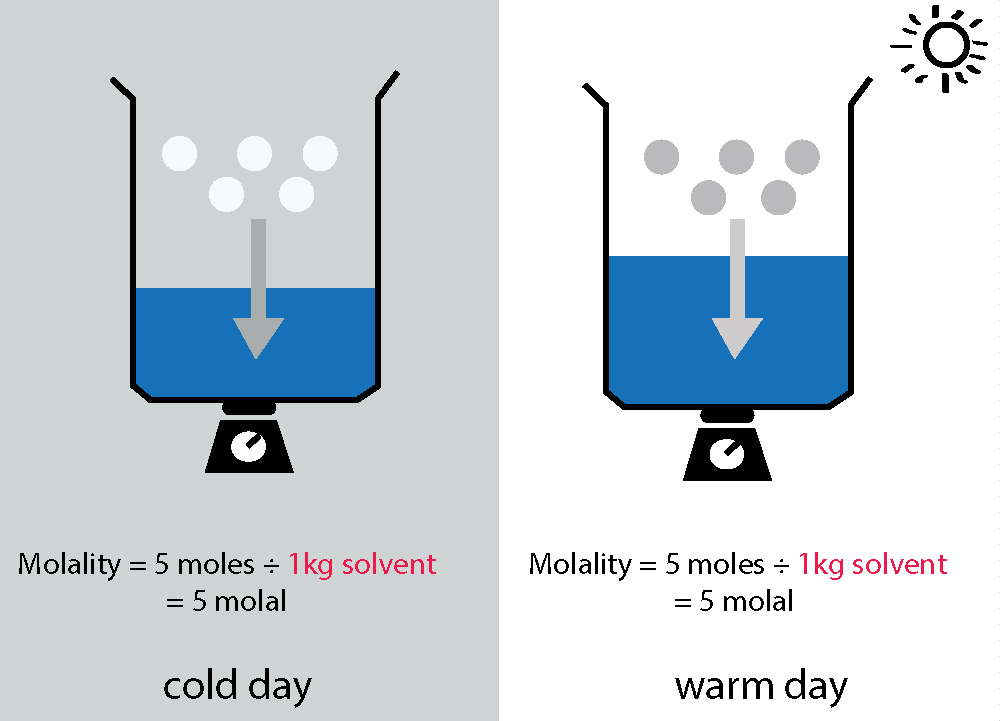
- Molality is independent of temperature since it depends on mass.
- Used in colligative properties (boiling point elevation, freezing point depression).
- Preferred in thermodynamic calculations.
Comparison Table
| Property | Molarity (M) | Normality (N) | Molality (m) |
|---|---|---|---|
| Formula | |||
| Units | mol/L (M) | eq/L (N) | mol/kg (m) |
| Temperature Dependence | Yes | Yes | No |
| Used in | Solutions & titrations | Acid-base, redox, precipitation reactions | Thermodynamic calculations |
| Depends on Volume? | Yes | Yes | No |
Conclusion
- Molarity (M) is most common in laboratory solutions but varies with temperature.
- Normality (N) is useful in titrations and reaction-based calculations.
- Molality (m) is temperature-independent and used in colligative property studies.
1. Mass Percent (Weight Percent, w/w%)
- Definition: The mass of solute present in 100 grams of solution.
- Formula:
- Example: If 10g of NaCl is dissolved in 90g of water, the mass percent is:
2. Volume Percent (v/v%)
- Definition: The volume of solute present in 100 mL of solution.
- Formula:
- Example: If 30 mL of ethanol is mixed with 70 mL of water, then:
3. Mass-Volume Percent (w/v%)
- Definition: The mass of solute present in 100 mL of solution.
- Formula:
- Example: If 5g of glucose is dissolved in 100 mL of water, the solution is 5% w/v glucose solution.
4. Parts per Million (ppm) & Parts per Billion (ppb)
- Definition: Used for very dilute solutions.
- Formula for ppm:
- Formula for ppb:
- Example: If 2 mg of a contaminant is dissolved in 1 kg of water, the concentration is 2 ppm.
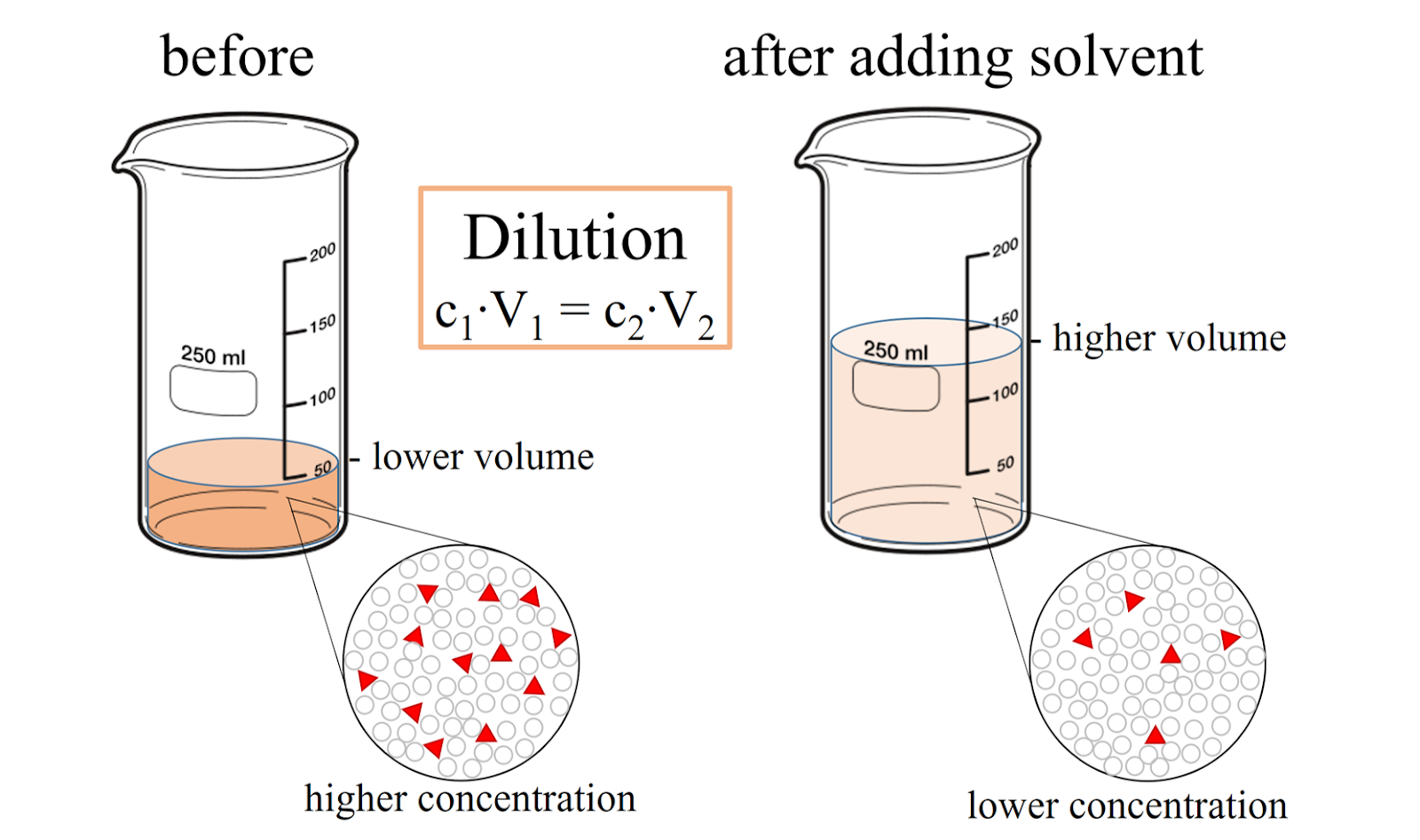
5. Dilution Formula
- Definition: When a solution is diluted, its concentration decreases while the total moles of solute remain the same.
- Formula:
- = Initial and final molarity
- = Initial and final volume
- Example: If 500 mL of a 2M HCl solution is diluted to 1L, the new molarity is:
6. Colligative Properties (Depend on Molality)
- Properties that depend on the number of solute particles, not their identity:
- Boiling Point Elevation
- Freezing Point Depression
- Vapor Pressure Lowering
- Osmotic Pressure
संघनता (Concentration) और इसके प्रकार
संघनता (Concentration) का अर्थ है घोल (solution) में घुले हुए विलेय (solute) की मात्रा। इसे विभिन्न मात्रकों में व्यक्त किया जाता है, जैसे मोलरता (Molarity - M), नॉर्मलता (Normality - N), और मोललता (Molality - m)।
1. मोलरता (Molarity - M)
परिभाषा:
मोलरता किसी घोल में प्रति लीटर घोल में उपस्थित विलयन की मोल संख्या को दर्शाती है।
इकाई:
मोलरता को मोल प्रति लीटर (mol/L या M) में व्यक्त किया जाता है।
उदाहरण:
यदि 5 मोल NaCl को 2 लीटर पानी में घोला जाता है, तो घोल की मोलरता होगी:
मुख्य बिंदु:
- मोलरता घोल के आयतन (volume) पर निर्भर करती है।
- यह तापमान (temperature) के अनुसार बदलती है क्योंकि तापमान बढ़ने से घोल का आयतन बदलता है।
- इसका उपयोग रासायनिक अभिक्रियाओं और टाइट्रेशन (titration) में किया जाता है।
2. नॉर्मलता (Normality - N)
परिभाषा:
नॉर्मलता किसी घोल में प्रति लीटर घोल में उपस्थित ग्राम-समतुल्य (gram-equivalents) की संख्या को दर्शाती है।
इकाई:
नॉर्मलता को समतुल्य प्रति लीटर (eq/L या N) में व्यक्त किया जाता है।
समतुल्य भार (Equivalent Weight) की गणना:
जहाँ n-कारक इस पर निर्भर करता है:
- अम्ल-क्षार अभिक्रिया (Acid-Base reactions) → H⁺ या OH⁻ की संख्या।
- रेडॉक्स अभिक्रिया (Redox reactions) → इलेक्ट्रॉनों का आदान-प्रदान।
- अवक्षेपण अभिक्रिया (Precipitation reactions) → आयन के आवेश पर निर्भर।
उदाहरण:
1N H₂SO₄ घोल तैयार करने के लिए:
- H₂SO₄ का अणुभार = 98 g/mol
- n-कारक = 2 (क्योंकि H₂SO₄ 2 H⁺ आयन छोड़ता है)
अतः 1N H₂SO₄ बनाने के लिए 49 ग्राम H₂SO₄ को 1 लीटर पानी में घोलना होगा।
मुख्य बिंदु:
- नॉर्मलता अभिक्रिया-विशिष्ट (reaction-specific) होती है।
- यह अम्ल-क्षार, रेडॉक्स और अवक्षेपण अभिक्रियाओं में उपयोगी है।
- यह तापमान पर निर्भर करती है क्योंकि आयतन बदल सकता है।
3. मोललता (Molality - m)
परिभाषा:
मोललता किसी घोल में प्रति 1 किलोग्राम विलायक (solvent) में घुले हुए विलेय की मोल संख्या को दर्शाती है।
इकाई:
मोललता को मोल प्रति किलोग्राम (mol/kg या m) में व्यक्त किया जाता है।
उदाहरण:
यदि 0.5 मोल ग्लूकोज को 250 ग्राम पानी में घोला जाता है, तो मोललता होगी:
मुख्य बिंदु:
- मोललता तापमान पर निर्भर नहीं करती क्योंकि यह द्रव्यमान पर आधारित होती है।
- यह कोलिगेटिव गुणों (colligative properties) (उबलने का बढ़ना, जमने का कम होना) के लिए उपयोगी है।
- यह ऊष्मागतिकी (thermodynamics) में प्रयोग की जाती है।
तुलनात्मक सारणी
| गुणधर्म | मोलरता (M) | नॉर्मलता (N) | मोललता (m) |
|---|---|---|---|
| सूत्र | |||
| इकाई | mol/L (M) | eq/L (N) | mol/kg (m) |
| तापमान पर निर्भरता | हाँ | हाँ | नहीं |
| प्रयोग में आता है | प्रयोगशाला घोल और टाइट्रेशन | अम्ल-क्षार, रेडॉक्स, अवक्षेपण अभिक्रिया | ऊष्मागतिकी और कोलिगेटिव गुण |
| आयतन पर निर्भरता? | हाँ | हाँ | नहीं |
निष्कर्ष
- मोलरता (M) प्रयोगशाला में आमतौर पर प्रयुक्त होती है, लेकिन तापमान के अनुसार बदलती है।
- नॉर्मलता (N) विशिष्ट रासायनिक अभिक्रियाओं में उपयोगी होती है।
- मोललता (m) तापमान-स्वतंत्र होती है और ऊष्मागतिक गुणों में उपयोगी होती है।
संबंधित विषय (Related Topics)
मोलरता, नॉर्मलता और मोललता से जुड़े कुछ महत्वपूर्ण विषय निम्नलिखित हैं:
1. द्रव्यमान प्रतिशत (Weight Percent, w/w%)
- परिभाषा: 100 ग्राम घोल में उपस्थित विलेय (solute) का द्रव्यमान।
- सूत्र:
- उदाहरण: यदि 10 ग्राम NaCl को 90 ग्राम पानी में घोला जाता है, तो द्रव्यमान प्रतिशत होगा:
2. आयतन प्रतिशत (Volume Percent, v/v%)
- परिभाषा: 100 mL घोल में उपस्थित विलेय का आयतन।
- सूत्र:
- उदाहरण: यदि 30 mL एथेनॉल को 70 mL पानी में मिलाया जाता है, तो:
3. द्रव्यमान-आयतन प्रतिशत (Mass-Volume Percent, w/v%)
- परिभाषा: 100 mL घोल में उपस्थित विलेय का द्रव्यमान।
- सूत्र:
- उदाहरण: यदि 5 ग्राम ग्लूकोज को 100 mL पानी में घोला जाता है, तो यह 5% w/v ग्लूकोज घोल होगा।
4. प्रति दस लाख भाग (Parts per Million, ppm) और प्रति अरब भाग (Parts per Billion, ppb)
- परिभाषा: बहुत कम सांद्रता (dilute solution) वाली विलयन के लिए प्रयुक्त होता है।
- ppm के लिए सूत्र:
- ppb के लिए सूत्र:
- उदाहरण: यदि 2 mg किसी प्रदूषक को 1 kg पानी में मिलाया जाता है, तो इसकी सांद्रता 2 ppm होगी।
5. विलयन का तनुकरण (Dilution Formula)
- परिभाषा: जब किसी घोल को तनु (dilute) किया जाता है, तो उसकी सांद्रता कम हो जाती है, लेकिन विलेय के कुल मोल समान रहते हैं।
- सूत्र:
जहाँ:
- = प्रारंभिक और अंतिम मोलरता
- = प्रारंभिक और अंतिम आयतन
- उदाहरण: यदि 500 mL 2M HCl घोल को 1 लीटर तक पतला किया जाए, तो नई मोलरता होगी:
6. कोलिगेटिव गुण (Colligative Properties) - मोललता पर निर्भर
कोलिगेटिव गुण वे होते हैं जो विलेय कणों की संख्या पर निर्भर करते हैं, न कि उनके प्रकार पर।
मुख्य कोलिगेटिव गुण निम्नलिखित हैं:
- संतलन वाष्प दाब का घटना (Vapor Pressure Lowering)
- उबलने का बढ़ना (Boiling Point Elevation)
- जमने का कम होना (Freezing Point Depression)
- परासरण दाब (Osmotic Pressure)
निष्कर्ष
- द्रव्यमान प्रतिशत, आयतन प्रतिशत, और ppm का उपयोग विभिन्न सांद्रता मापने के लिए किया जाता है।
- Dilution formula प्रयोगशाला में घोल बनाने में सहायक होता है।
- कोलिगेटिव गुण भौतिक गुणों को प्रभावित करते हैं और ऊष्मागतिकी (thermodynamics) में महत्वपूर्ण होते हैं।






Comments
Post a Comment